Advertisement
Grab your lab coat. Let's get started
Welcome!
Welcome!
Create an account below to get 6 C&EN articles per month, receive newsletters and more - all free.
It seems this is your first time logging in online. Please enter the following information to continue.
As an ACS member you automatically get access to this site. All we need is few more details to create your reading experience.
Not you? Sign in with a different account.
Not you? Sign in with a different account.
ERROR 1
ERROR 1
ERROR 2
ERROR 2
ERROR 2
ERROR 2
ERROR 2
Password and Confirm password must match.
If you have an ACS member number, please enter it here so we can link this account to your membership. (optional)
ERROR 2
ACS values your privacy. By submitting your information, you are gaining access to C&EN and subscribing to our weekly newsletter. We use the information you provide to make your reading experience better, and we will never sell your data to third party members.
Synthesis
Cuando jugamos a oxidar, una enzima gana a los catalizadores
La evolución dirigida produce una enzima que oxida alquenos de una forma única
by Stu Borman
October 12, 2017
| A version of this story appeared in
Volume 95, Issue 41
La oxidación del carbono final de un alqueno terminal para formar un aldehído, una reacción denominada oxidación de alquenos anti-Markovnikov, es un proceso difícil puesto que la reacción es energéticamente desfavorable. El proceso termodinámicamente favorable es aquel que lleva la selectividad Markovnikov, es decir, la oxidación del penúltimo carbono de la cadena del sustrato, para dar lugar a una cetona en lugar de un aldehído.
Los químicos han buscado desde hace tiempo mejores procesos para lograr selectividad anti-Markovnikov en la oxidación de alquenos para, por ejemplo, transformar los aldehídos en alcoholes lineales, que se usan habitualmente en aromas, perfumes, lubricantes y cosméticos. Hay catalizadores que pueden llevar a cabo esta complicada oxidación anti-Markovnikov, pero tiene lugar con muy bajo rendimiento y no es enantioselectiva.
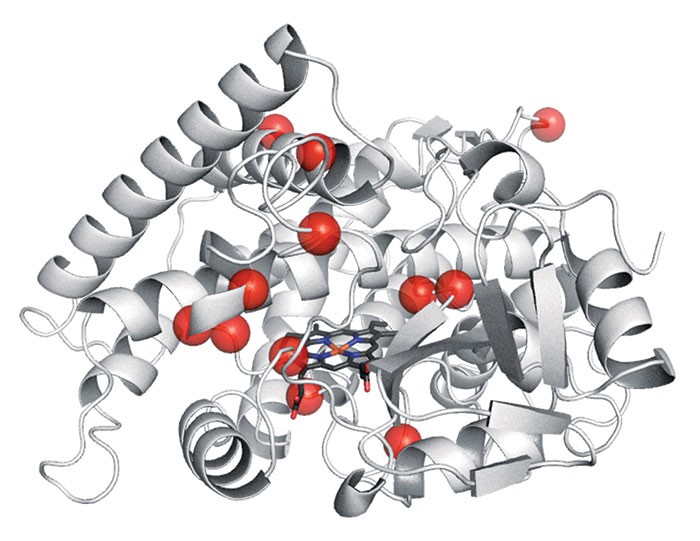
El investigador Frances H. Arnold y su equipo en Caltech (California Institute of Technology, Pasadena, EEUU) pensaron que una enzima modificada podría tener éxito allí donde los catalizadores tradicionales lo habían intentado. Este equipo publica ahora el uso de la evolución dirigida, un método iterativo de mutación de la proteína y ensayo de la actividad, para la identificación de sustituciones en aminoácidos que convierten una enzima en un catalizador de oxidación de alquenos con selectividad predominantemente anti-Markovnikov (Science 2017, DOI: 10.1126/science.aao1482).
Esta enzima modificada, denominada aMOx, cataliza 3800 ciclos (o turnovers) de la reacción de oxidación antes de perder fuelle, lo que la hace ciertamente productiva comparada con los menos de 10 ciclos descritos para anteriores catalizadores de oxidación anti-Markovnikov. La enzima, junto con otros reactivos y catalizadores, podría un día convertir alquenos terminales en una variedad de aldehídos, alcoholes y aminas para su uso como materia prima y como productos elaborados, farmacéuticos y agroquímicos.

Los investigadores de Caltech comenzaron con una enzima de tipo citocromo P450, basada en hierro, que se denomina P450LA1. Esta enzima cataliza un proceso relacionado, la oxidación de alquenos con oxo-complejos metálicos, en el cual un oxígeno unido a metal ataca el doble enlace, formando normalmente un epóxido. Un trabajo previo de otro grupo había encontrado que P450LA1 producía también un 19% de aldehído como subproducto por apertura del epóxido. En el nuevo estudio, el investigador postdoctoral Stephan C. Hammer, ahora en la Universidad de Stuttgart (Alemania), encontró que la enzima realmente producía un 45% de aldehído de forma directa, sin pasar por el intermedio de tipo epóxido.
Entonces los investigadores llevaron a cabo 10 ciclos de evolución dirigida, utilizando estireno como sustrato, para incrementar la selectividad anti-Markovnikov desde el 45 hasta el 81% en aMOx. La enzima aMOx funciona bien puesto que estabiliza los radicales de alta energía y los intermedios carbocatiónicos que se generan cuando su grupo hierro-oxo ataca el alqueno terminal del estireno, permitiendo la formación preferente de aldehído anti-Markovnikov.
Hicieron falta 12 mutaciones distribuidas a lo largo de toda la proteína para transformar P450LA1 en aMOx. “Nadie puede explicar cómo estas sustituciones proporcionan esta selectividad a la reacción, y mucho menos predecirlas”, dice Arnold. “Esto ilustra el poder de la evolución dirigida para fabricar catalizadores que se les hayan podido escapar a los químicos.”
Las ventajas clave de la enzima modificada incluyen su enantioselectividad y su número de ciclos catalizados o turnovers, “que de momento es probable que no sea suficiente para hacerlo viable comercialmente, pero que ya son bastante respetables”, explica John T. Groves, especialista en catálisis biomimética de la Universidad de Princeton (Nueva Jersey, EEUU).
Hay actualmente una corriente en la academia y en la industria para sustituir reacciones catalíticas convencionales por procesos enzimáticos que tengan lugar en agua como disolvente a temperatura y presión ambientales, que funcionen en sistemas de flujo y que no requieran la separación del catalizador, dice Groves. “Últimamente se han establecido lazos con la biocatálisis por todas estas razones. Este nuevo estudio es un paso importante en la dirección correcta”.
Traducción al español producida por Esteban Urriolabeitia de Divulgame.org para C&EN. La versión original (en inglés) del artículo está disponible aquí.



Join the conversation
Contact the reporter
Submit a Letter to the Editor for publication
Engage with us on Twitter