Advertisement
Grab your lab coat. Let's get started
Welcome!
Welcome!
Create an account below to get 6 C&EN articles per month, receive newsletters and more - all free.
It seems this is your first time logging in online. Please enter the following information to continue.
As an ACS member you automatically get access to this site. All we need is few more details to create your reading experience.
Not you? Sign in with a different account.
Not you? Sign in with a different account.
ERROR 1
ERROR 1
ERROR 2
ERROR 2
ERROR 2
ERROR 2
ERROR 2
Password and Confirm password must match.
If you have an ACS member number, please enter it here so we can link this account to your membership. (optional)
ERROR 2
ACS values your privacy. By submitting your information, you are gaining access to C&EN and subscribing to our weekly newsletter. We use the information you provide to make your reading experience better, and we will never sell your data to third party members.
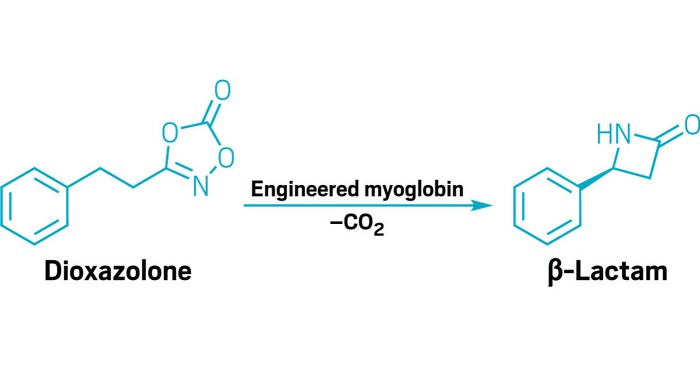
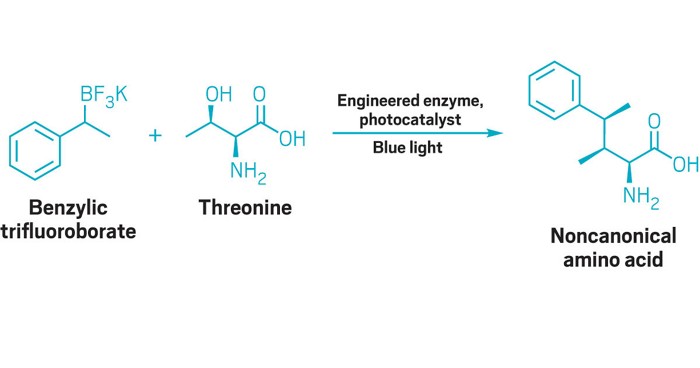
Biocatalysis
C&EN En Español
Diseñan una enzima artificial para reacciones de Diels-Alder rápidas y selectivas
Combinan el diseño y la evolución dirigida para producir una enzima artificial con un rendimiento récord
by Leigh Krietsch Boerner
February 8, 2021
| A version of this story appeared in
Volume 99, Issue 5

Acceda a todo el contenido español de C&EN en cenm.ag/espanol.
Utilizando diseño computacional y evolución dirigida, los científicos han creado con éxito una metaloproteína que puede catalizar una reacción orgánica común de manera más eficiente que cualquier enzima conocida (Nat. Chem., 2021 DOI: 10.1038/s41557-020-00628-4). Un equipo dirigido por Donald Hilvert de la Escuela Politécnica Federal de Zúrich (ETH Zürich, Suiza) y Gonzalo Jiménez-Osés del Consorcio Cientifico-Tecnológico Vasco (BRTA, Basque Research and Technology Alliance, España) diseñó una nueva enzima para catalizar la reacción de Diels-Alder, que rompe dos dobles enlaces para formar un nuevo compuesto cíclico y que se utiliza frecuentemente en industria y academia. La proteína del grupo produce el compuesto final más de un orden de magnitud más rápido que cualquier enzima Diels-Alderasa caracterizada previamente y con más del 99% de selectividad.
Las reacciones de Diels-Alder, a menudo catalizadas por un metal que se comporta como un ácido de Lewis, pueden producir múltiples productos a partir del mismo conjunto de reactivos, especialmente si esos reactivos contienen varios dobles enlaces. Las enzimas pueden favorecer ciertos productos en particular bloqueando los reactivos y el catalizador metálico en una orientación específica entre sí. Pero las reacciones enzimáticas de Diels-Alder publicadas con anterioridad tardan días en crear sus productos con una regioselectividad entre moderada y buena. Es decir, la enzima dirige su acción a un conjunto específico de enlaces en la molécula, pero estos enlaces aún pueden romperse y formarse de varias maneras, produciendo más de un producto.

Para hacer una mejor enzima, el equipo usó primero la teoría del funcional de la densidad (DFT, por sus siglas en inglés) para examinar el bolsillo de unión de una proteína de unión a zinc de 97 aminoácidos de longitud llamada MID1sc, con la esperanza de aprovechar el zinc de su núcleo para catalizar la reacción de Diels-Alder. Identificaron ciertos sitios para mutar que los modelos predijeron que podrían reducir la barrera de reacción para hacer un producto Diels-Alder con alta regioselectividad. Los investigadores sometieron la enzima a siete rondas de evolución dirigida (un método que selecciona las variantes con mejor rendimiento de un archivo de proteínas mutadas) en busca de nuevas proteínas con una actividad Diels-Alder mejorada.
La proteína resultante era más de un orden de magnitud más rápida y específica para producir un isómero y un compuesto en particular, en este caso, el endodihidropirano.
La clave tanto para la alta actividad como para la regioselectividad de esta enzima fue el ajuste del estado de transición en el bolsillo de unión, dice Hilvert. Durante el curso de la evolución, la forma de este bolsillo cambió, uniendo los sustratos en un ángulo mejor para que reaccionen, creando una red estabilizadora de enlaces de hidrógeno y extrayendo el hidrógeno del grupo amino del 3-vinilindol para que pueda atacar al heterodieno de manera más eficiente (como puede verse en la figura). “No planeamos nada de esto, surgió de la evolución [dirigida]”, dice Hilvert.
En los estudios computacionales, los investigadores demostraron que el enantiómero no deseado no encajaría en el bolsillo de unión, mientras que el enantiómero correcto para los productos observados “encaja maravillosamente, como una mano en un guante”, comenta Hilvert. “Pudimos tomar una estructura que inicialmente no tenía actividad y convertirlo en algo realmente bastante activo”, añade. “Es un gran salto en eficiencia”.
El equipo estudió la reacción de azachalcona con 3-vinilindol porque los productos contienen partes nitrogenadas que se encuentran comúnmente en compuestos farmacéuticos. Este trabajo es un gran paso en el diseño de enzimas artificiales para producir compuestos orgánicos importantes con alta estereo y regioselectividad, dice William F. DeGrado, químico farmacológico de la Universidad de California en San Francisco (EE.UU.).
Traducido al español por Greco González Miera para C&EN. La versión original (en inglés) de este artículo está disponible aquí.


Join the conversation
Contact the reporter
Submit a Letter to the Editor for publication
Engage with us on Twitter