Advertisement
Grab your lab coat. Let's get started
Welcome!
Welcome!
Create an account below to get 6 C&EN articles per month, receive newsletters and more - all free.
It seems this is your first time logging in online. Please enter the following information to continue.
As an ACS member you automatically get access to this site. All we need is few more details to create your reading experience.
Not you? Sign in with a different account.
Not you? Sign in with a different account.
ERROR 1
ERROR 1
ERROR 2
ERROR 2
ERROR 2
ERROR 2
ERROR 2
Password and Confirm password must match.
If you have an ACS member number, please enter it here so we can link this account to your membership. (optional)
ERROR 2
ACS values your privacy. By submitting your information, you are gaining access to C&EN and subscribing to our weekly newsletter. We use the information you provide to make your reading experience better, and we will never sell your data to third party members.
Vaccines
C&EN En Español
La vacuna de Pfizer contra la COVID-19 se empieza a aplicar por todo EE. UU.
La vacunación ha arrancado, pero aún queda un largo camino por recorrer para esta y otras vacunas
by Ryan Cross
December 20, 2020
| A version of this story appeared in
Volume 98, Issue 48

Acceda a todo el contenido español de C&EN en cenm.ag/espanol.
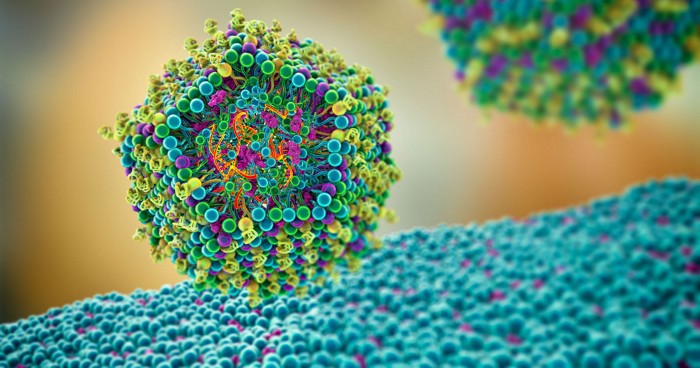
Los trabajadores de la salud se arremangaron el pasado lunes 14 de diciembre para administrar las inyecciones de la primera vacuna contra la COVID-19 autorizada por la FDA. Fue un debut impresionante para la primera vacuna de ARN mensajero (ARNm) del mundo, desarrollada de forma conjunta entre Pfizer y BioNTech. Los científicos han estado trabajando en la tecnología de las vacunas de ARNm durante más de dos décadas, con el sueño de que algún día se utilizase para el desarrollo rápido de vacunas contra una pandemia.
Ese sueño se hizo realidad el 11 de diciembre, cuando la FDA permitió que se usara la vacuna tras haber analizado los resultados de un ensayo clínico de 44 000 personas, que mostraron que era 95% efectiva en la prevención de la COVID-19. Dos días después, los primeros camiones de FedEx y UPS salieron de la planta de fabricación de Pfizer en Portage, Michigan, donde las vacunas se fabricaron y se cargaron en cajas llenas de hielo seco. Las vacunas ofrecían una esperanza optimista tras la semana más mortífera de la pandemia en Estados Unidos.
“Se trata de un logro científico realmente asombroso”, declara Srilatha Edupuganti, médica especialista en enfermedades infecciosas de la Clínica Hope del Centro de Vacunas Emory (Georgia, EEUU). “Estoy muy emocionada con esta vacuna, que va a prevenir contagios y mortalidad”.
Daniel Hoft, director del Centro de Desarrollo de Vacunas de la Universidad de Saint Louis (Misuri, EEUU) y miembro del Comité Asesor Nacional de Vacunas, también está satisfecho con la noticia. “Nadie pensó que las primeras vacunas probadas en fase 3 pudieran ser tan efectivas y sin presentar problemas importantes de seguridad. Así que este es realmente un gran hito”, nos escribe en un correo electrónico.
El suministro de la vacuna es limitado y no habrá suficiente para todos aquellos que la deseen. En julio, el gobierno de Estados Unidos pagó 1 950 millones de dólares para reservar 100 millones de dosis (lo suficiente para vacunar a 50 millones de personas, ya que la vacuna requiere dos inyecciones con tres semanas de diferencia). Pfizer espera que se puedan distribuir hasta 25 millones de dosis en los EE. UU. antes de fin de año, y el resto se proporcionará a lo largo de los primeros meses de 2021.
Vacunar al país entero, y al mundo entero, requerirá vacunas adicionales contra la COVID-19, que hayan superado los ensayos clínicos y obtenido la autorización de la FDA. El gobierno de los Estados Unidos incrementó recientemente sus reservas de otra vacuna de ARNm, fabricada por Moderna, subiendo su pedido a 200 millones de dosis. A la hora de la impresión de C&EN, el comité asesor de vacunas de la FDA, compuesto por médicos de enfermedades infecciosas e investigadores en vacunas, se había reunido para escuchar los datos más recientes sobre esa vacuna. El comité votó abrumadoramente a favor de su uso en personas mayores de 18 años, en base a los resultados preliminares positivos divulgados por primera vez en noviembre, así como resultados más detallados publicados el 15 de diciembre en la web de la FDA.
En función de los resultados de los estudios clínicos en fase 3 que se están llevando a cabo ahora mismo, tres compañías más—AstraZeneca, Johnson & Johnson y Novavax—podrían estar listas para pedir la autorización de sus vacunas en los primeros meses de 2021.
Aunque la FDA trabajó a una enorme velocidad para revisar los datos de Pfizer, las palabras y acciones de la agencia también indican que sus líderes no cedieron a la presión política por acelerar indebidamente la autorización de la vacuna. Otros cinco países — Baréin, Canadá, México, Arabia Saudí y el Reino Unido — autorizaron la vacuna antes que Estados Unidos.
La FDA dio luz verde a la vacuna para su uso en personas mayores de 16 años a través de la autorización de uso de emergencia (EUA), que requiere dos meses de seguimiento después de que los participantes del ensayo clínico reciban su segunda inyección. Una aprobación formal de la FDA requerirá de seis meses de seguimiento. Pfizer planea presentar una solicitud de licencia de productos biológicos para obtener dicha aprobación formal en 2021.
Pfizer y BioNTech anunciaron una colaboración para desarrollar una vacuna para la COVID-19 el 17 de marzo. Aunque habían comenzado a trabajar juntos en vacunas experimentales contra la gripe en 2018, nunca habían realizado un ensayo clínico grande para demostrar la eficacia de una vacuna de ARNm. Los primeros voluntarios fueron inyectados con la vacuna en Alemania en abril y en Estados Unidos en mayo. El estudio en fase 3 comenzó en julio y las empresas anunciaron los resultados preliminares (exitosos) en noviembre.
Un artículo posterior, revisado por pares, mostró que la vacuna tenía un 50% de eficacia durante las tres semanas entre la primera y la segunda inyección y aproximadamente un 95% siete días después de la segunda inyección, que es el dato principal que Pfizer enfatizó al buscar su EUA (N. Engl. J. Med. 2020, DOI: 10.1056/NEJMoa2034577).
El nivel de eficacia es “realmente notable”, comunica por correo electrónico Asunción Mejías, doctora en enfermedades infecciosas del Centro de Vacunas e Inmunidad del Nationwide Children’s Hospital (Ohio, EEUU). Una de las grandes preguntas es cuánto tiempo durará la inmunidad transmitida por la vacuna. “Esperamos que la eficacia de la vacuna seguirá siendo igual de alta”, dice, pero la inmunidad colectiva podría lograrse “con vacunas cuya eficacia fuera incluso un poco menor”.
La vacuna de Moderna presentó un 94% de eficacia a la hora de prevenir la COVID-19 a los dos días de la segunda dosis, según un estudio con 30 000 personas. A pesar de que 30 personas de las que recibieron el placebo desarrollaron COVID-19 severa, ninguna de las personas que recibieron la vacuna lo hicieron.
La autorización de la FDA para la vacuna de Pfizer se produjo un día después de que el comité asesor de vacunas de la agencia votara 17 a 4 a favor de autorizarla. Tras nueve horas de reunión, algunos miembros del comité se opusieron a autorizar el uso de la vacuna en jóvenes de 16 y 17 años. H. Cody Meissner, jefe de enfermedades infecciosas pediátricas de la Facultad de Medicina de la Universidad Tufts (Massachusetts, EEUU), dijo que los datos de Pfizer eran insuficientes para justificar la administración de la vacuna a jóvenes de 16 y 17 años. Solicitó, en vano, que la FDA cambiase el texto para autorizar la vacuna en adultos mayores de 18 años. Se abstuvo en la votación.
Sin embargo, es poco probable que gran parte de los jóvenes sean los primeros en recibir la vacuna. Los Centros para el Control y la Prevención de Enfermedades de EE. UU. (CDC por sus siglas en inglés) comunicaron que la primera ola de vacunas debería administrarse a los trabajadores de la salud que tratan a pacientes y residentes de centros de atención a largo plazo. La próxima ola incluirá a otros trabajadores de la salud, trabajadores esenciales y adultos con afecciones médicas, como cáncer y diabetes, que los sitúa en alto riesgo por COVID-19 severa.
Ahora que la vacuna ya ha sido autorizada, ha comenzado la difícil tarea de distribuirla y administrarla. Las dosis deben enviarse y almacenarse a aproximadamente -70 ° C, y Pfizer está utilizando hielo seco y contenedores especiales para mantenerlas frías. Tras su llegada, la vacuna se puede mantener refrigerada a 2-8 °C hasta por cinco días. Pfizer dice que está apostando por un sistema que permita tener intervalos mínimos entre la fabricación, el envío y la administración de las vacunas.
Las instituciones médicas han comenzado a priorizar la administración de vacunas a los miembros de su personal. “Se les pide a los estados que básicamente resuelvan esto por sí mismos. No viene ordenado a nivel federal”, dice Edupuganti. Aunque el gobierno está poniendo la vacuna a disposición de forma gratuita, los estados y las instalaciones médicas asumen el costo de administrarla y hacer un seguimiento de los receptores, lo que incluye asegurarse de que regresen para recibir la vacuna de refuerzo tres semanas después.
Debido a que nunca antes se habían elaborado cantidades tan ingentes de una vacuna de ARNm, retrasos en la producción y el lanzamiento de las vacunas no deberían de ser una sorpresa. Pfizer ya experimentó un retraso en la producción de materia prima para su vacuna, lo que le llevó a recortar su objetivo para 2020 de 100 millones de dosis a 50 millones.
Hay algunas preguntas pendientes sobre para quién y cómo de bien funcionará la vacuna de Pfizer. La empresa no sabe si la vacuna es segura y eficaz para los niños menores de 16 años, las mujeres embarazadas y las personas inmunodeprimidas. La empresa está planificando estudios adicionales con estos grupos.
Y aunque la vacuna protege de forma clara contra la enfermedad, Pfizer continúa recopilando datos sobre si también reduce la propagación de la infección. Hasta que lo sepamos, aclara Mejías, es importante que las personas vacunadas sigan las medidas como hasta ahora: usar máscaras y mantener el distanciamiento físico para evitar la propagación no intencionada del virus.
Los médicos también deberán permanecer atentos a los efectos secundarios más escasos, aquellos que salen a la luz solo cuando se ha administrado la vacuna a millones de personas, dice Edupuganti. Dos personas en el Reino Unido con antecedentes de alergias graves experimentaron anafilaxia tras recibir la inyección. Los CDC recomiendan que los médicos controlen a todas las personas que reciben la vacuna durante 15 minutos y a las que tienen antecedentes de anafilaxia durante 30 minutos.
Las personas que reciben la vacuna Pfizer deben esperar algunos efectos secundarios, como fatiga, dolor de cabeza, dolor muscular y escalofríos. Estas reacciones están dentro del rango habitual de efectos secundarios producidos por las vacunas ya existentes, según Edupuganti. “Esta vacuna contra la COVID-19 es más reactogénica que una vacuna contra la gripe, pero menos reactogénica que algunas vacunas, como la vacuna contra el herpes zóster”, dice.
Al mismo tiempo que Pfizer esperaba la autorización de su vacuna el 11 de diciembre, otros dos grupos informaron retrasos en sus vacunas COVID-19 basadas en la tecnología más tradicional de proteínas recombinantes. CSL Behring y la Universidad de Queensland anunciaron que abandonaban su vacuna, mientras que Sanofi y GlaxoSmithKline dijeron que su ensayo se retrasaría.
Los investigadores de Queensland han modificado la proteína de espícula del coronavirus con aminoácidos derivados de una proteína del VIH, destinada a estimular la inmunidad. De forma inesperada, los receptores de la vacuna desarrollaron anticuerpos contra el VIH. Las pruebas de seguimiento confirmaron que en realidad no estaban infectadas con el VIH, pero CSL y el gobierno australiano decidieron abandonar la vacuna en lugar de cambiar los procedimientos de prueba del VIH existentes.
La vacuna de Sanofi-GSK tuvo buenas respuestas inmunes en personas menores de 50 años, pero no en las mayores de 50, probablemente porque la concentración de antígeno, la proteína en espícula, no era lo suficientemente alta, declaran las empresas. Aunque las empresas estaban planeando comenzar un ensayo de Fase 3 este mes, ahora se plantean reformular la vacuna y probarla en un estudio de Fase 2b a partir de febrero. El objetivo original de autorizar la vacuna a mediados de 2021 se ha pospuesto hasta fin de año.
“Esto frena el desarrollo clínico de estas vacunas, pero aún pueden ser optimizadas y contribuir a los planes de vacunación a nivel mundial para superar esta pandemia”, dice Hoft de la Universidad Saint Louis.
Traducido al español por Juan José Sáenz de la Torre para C&EN. La versión original (en inglés) de este artículo está disponible aquí.



Join the conversation
Contact the reporter
Submit a Letter to the Editor for publication
Engage with us on Twitter