Advertisement
Grab your lab coat. Let's get started
Welcome!
Welcome!
Create an account below to get 6 C&EN articles per month, receive newsletters and more - all free.
It seems this is your first time logging in online. Please enter the following information to continue.
As an ACS member you automatically get access to this site. All we need is few more details to create your reading experience.
Not you? Sign in with a different account.
Not you? Sign in with a different account.
ERROR 1
ERROR 1
ERROR 2
ERROR 2
ERROR 2
ERROR 2
ERROR 2
Password and Confirm password must match.
If you have an ACS member number, please enter it here so we can link this account to your membership. (optional)
ERROR 2
ACS values your privacy. By submitting your information, you are gaining access to C&EN and subscribing to our weekly newsletter. We use the information you provide to make your reading experience better, and we will never sell your data to third party members.
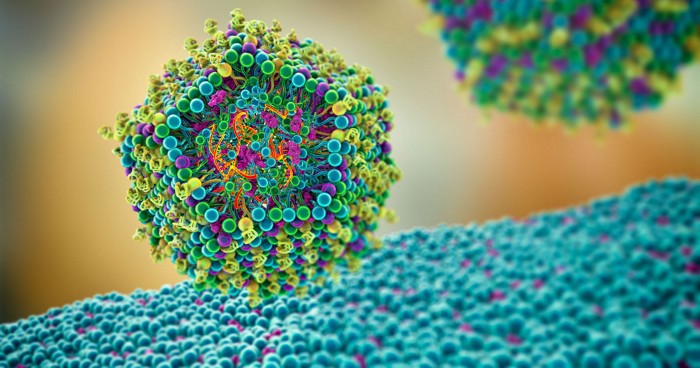
Vaccines
C&EN En Español
Sigue la pausa en la vacuna de J&J
El Comité Asesor sobre Prácticas de Vacunación de los Centros para el Control y Prevención de Enfermedades (CDC, por sus siglas en inglés) vigilará y aguardará antes de tomar una decisión acerca de la vacuna de J&J.
by Ryan Cross
April 16, 2021
| A version of this story appeared in
Volume 99, Issue 14

Acceda a todo el contenido español de C&EN en cenm.ag/espanol.
Una pausa temporal en la administración de la vacuna contra la COVID-19 de Johnson&Johnson en los Estados Unidos, probablemente permanezca vigente durante una semana o más, mientras los científicos y agentes reguladores de vacunas observan más casos de los raros, pero graves, coágulos de sangre que ha desarrollado un pequeño grupo de inmunizados con la vacuna de J&J.
Más de 6,8 millones de personas han recibido la vacuna de J&J en los Estados Unidos entre su autorización de uso emergencia, el pasado 27 de febrero, y la pausa recomendada por la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA, por sus siglas en inglés) y los CDC el 13 de abril. Durante este tiempo, la FDA y los CDC recibieron informes de seis mujeres que desarrollaron trombosis en los senos venosos cerebrales (CVST), un coágulo de sangre peligroso en el cerebro; y trombocitopenia, una condición que se refiere a bajos niveles de plaquetas.
El parón se produjo una semana después de que los reguladores europeos determinaron que la vacuna contra la COVID-19 de AstraZeneca estaba relacionada con casos raros y, ocasionalmente letales, de CVST con trombocitopenia. Ambas, la de AstraZeneca y la de J&J, son vacunas de vectores de adenovirus. La aparición similar e inusual de coágulos y bajos niveles de plaquetas observados en los inmunizados con ambas vacunas, llevó a los agentes de los CDC y la FDA a detener el uso de la vacuna de J&J. La compañía J&J también decidió pausar voluntariamente la distribución de su vacuna en Europa.
El 14 de abril, el Comité Asesor sobre Prácticas de Vacunación (ACIP) de los CDC, un equipo independiente de científicos que hace recomendaciones sobre cómo deben ser usadas las vacunas, realizó una reunión de emergencia para discutir el uso de la vacuna de J&J.
Durante la reunión, Tom Shimabukuro, científico de los CDC, dijo que los CDC y la FDA supieron de los casos de CVST y trombocitopenia a través del Sistema de Notificación de Eventos Adversos de Vacunas, que permite a los trabajadores de la salud, pacientes y cuidadores informar acerca de efectos observados después de la vacunación. El sistema ”funcionó exactamente como era esperado en este caso”, añadió.
La CVST es una afección grave y poco común, y los seis casos notificados en personas que recibieron la vacuna de J&J son entre 4 a 15 veces superiores a la tasa esperada, dijo Shimabukuro. Sin embargo, incluso esa predicción pudo haber sido subestimada, agregó, ya que no se consideró la inusual combinación de CVST con niveles bajos de plaquetas. Él describió la combinación de ambas condiciones como una “paradoja” debido a que las plaquetas generalmente facilitan la coagulación de la sangre.
El comité discutió otro hallazgo desconcertante: cinco de las seis mujeres dieron positivo en una prueba de anticuerpos contra una proteína de coagulación llamada factor plaquetario 4 (PF4). Varias de las personas que desarrollaron coágulos y trombocitopenia después de recibir la vacuna de AstraZeneca también tenían anticuerpos PF4. Los investigadores aún están intentando comprender el origen de estos anticuerpos y su papel en estos efectos secundarios graves. Algunos científicos especulan que el problema puede estar en la tecnología de la vacuna de vector de adenovirus, utilizada en ambos inmunizantes AstraZeneca y J&J, aunque no está claro cómo los vectores de adenovirus desencadenarían el desarrollo de los anticuerpos PF4 o por qué los casos son tan raros.
En el momento de la reunión de ACIP, una de las seis mujeres que desarrollaron los coágulos de sangre poco comunes después de recibir las vacuna J&J había muerto, tres permanecían hospitalizadas, y dos se estaban recuperando en sus casas. Los síntomas de la coagulación se desarrollaron entre los 6 y 13 días después de la vacunación. Considerando este tiempo, Sara Oliver, del Servicio de Inteligencia Epidémica de los CDC, estimó que era probable que los casos de coagulación y trombocitopenia hubieran ocurrido en personas vacunadas antes del 30 de marzo. Pero podrían surgir más incidentes entre las personas inmunizadas a partir del 30 de marzo, y los CDC están atentos a nuevos informes.
Por esta razón, los miembros del comité ACIP decidieron retrasar la toma de nuevas decisiones sobre la vacuna de J&J. Es probable que la pausa continúe durante al menos una semana hasta que el comité se reúna nuevamente para evaluar cualquier nuevo dato. Con el parón dará tiempo a que los trabajadores de la salud conozcan los riesgos potenciales de la vacuna de J&J, y a monitorear el surgimiento de síntomas entre los que recibieron la inyección.
Si las agencias deciden que los coágulos son causados por la vacuna, enfrentarán la difícil decisión de sopesar los riesgos poco comunes que presenta la inyección, con los más frecuentes riesgos que presenta la COVID-19. Cuando los CDC y la FDA anunciaron la pausa, el promedio de muertes relacionadas a la COVID-19 de los últimos 7 días en los Estados Unidos aún permanecía en más de 700 por día. Las agencias tendrán que elegir entre dejar la vacuna en el mercado, limitar su uso a ciertos datos demográficos, o retirarla por completo.
Hasta el momento, se han administrado en los Estados Unidos más de 180 millones de dosis de la vacuna de ARN mensajero de Pfizer y Moderna, sin informes de personas que hayan desarrollado CVST o trombocitopenia después de la vacunación.
Traducido al español por Gabriela Tormet-González para C&EN. La versión original (en inglés) de este artículo está disponible aquí.



Join the conversation
Contact the reporter
Submit a Letter to the Editor for publication
Engage with us on Twitter