Advertisement
Grab your lab coat. Let's get started
Welcome!
Welcome!
Create an account below to get 6 C&EN articles per month, receive newsletters and more - all free.
It seems this is your first time logging in online. Please enter the following information to continue.
As an ACS member you automatically get access to this site. All we need is few more details to create your reading experience.
Not you? Sign in with a different account.
Not you? Sign in with a different account.
ERROR 1
ERROR 1
ERROR 2
ERROR 2
ERROR 2
ERROR 2
ERROR 2
Password and Confirm password must match.
If you have an ACS member number, please enter it here so we can link this account to your membership. (optional)
ERROR 2
ACS values your privacy. By submitting your information, you are gaining access to C&EN and subscribing to our weekly newsletter. We use the information you provide to make your reading experience better, and we will never sell your data to third party members.
Drug Delivery
C&EN 中文版
没有这些脂质壳, 就没有针对COVID-19的信使RNA疫苗
用于COVID-19疫苗的脆弱的信使RNA(mRNA)分子无法自行进入细胞。它们在疫苗上的成功应用归功于花了数十年时间精制的脂质纳米颗粒。
by Ryan Cross
March 8, 2021
| A version of this story appeared in
Volume 99, Issue 8

请访问cenm.ag/chinese或关注ACS微信订阅号获取更多《化学与化工新闻》的中文内容.
目前信使RNA非常流行。今年,数以亿计的人将接种辉瑞-BioNTech公司(Pfizer-BioNTech)或莫德纳(Moderna)公司研发的COVID-19疫苗。每一剂疫苗的关键成分是信使RNA,它是一种短时间存在的携带遗传信息的链状物质,促使我们的细胞开始制造SARS-CoV-2蛋白,这些蛋白帮助我们的免疫系统产生抗体,防止将来可能发生的感染。得益于对信使RNA疫苗几十年科学研究的坚持不懈、数十亿美元的技术投资以及之前对冠状病毒的研究,疫苗制造商们才能在不到一年的时间内设计出疫苗并证明其安全性和有效性。
这些COVID-19疫苗取得了显著成功,但是这样的成功曾经看起来遥不可及,完全不能保证。信使RNA是异常精妙的物质。环境中和我们身体中的酶可以迅速把它们切成碎片,因此实验室中有关信使RNA的实验很困难,并且将它们输送到我们的细胞内也令人望而生畏。除此之外,信使RNA链很大且带负电,不能简单地穿过细胞的保护性脂质膜。因此,许多科学家认为这项技术永远行不通。
“有很多很多的怀疑论者。”Frank DeRosa说。他从2008年开始研究信使RNA,现在是Translate Bio的首席技术官。Translate Bio是一家与赛诺菲合作开发信使RNA疫苗的公司。“人们过去常说,如果你看待它的角度是错误的,它就会破碎成碎片。”
幸运的是,科学家们找到了解决办法。为了保护这种脆弱的分子潜入细胞,他们借助了一种比信使RNA疗法本身应用更早的传递技术:称为脂质纳米粒(lipid nanoparticles,简称LNPs)的微小脂肪球。
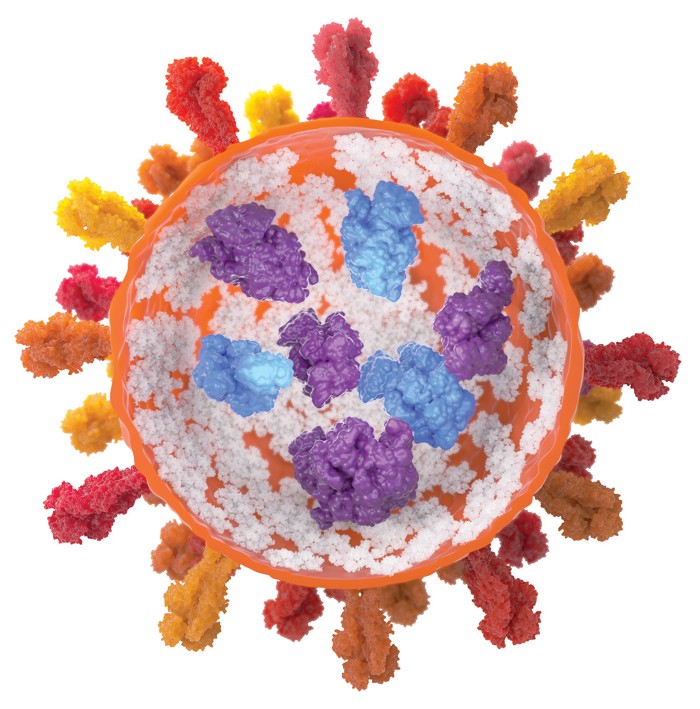
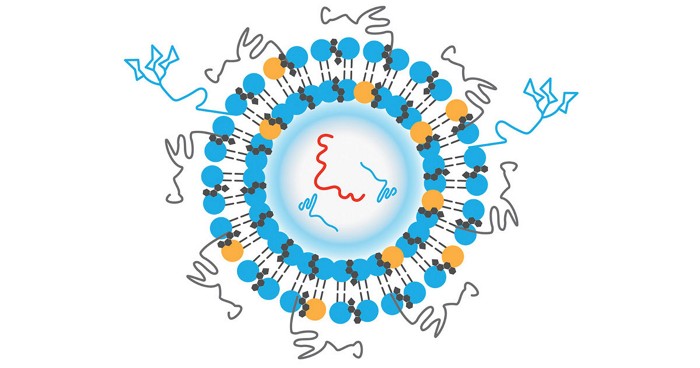
COVID-19疫苗中使用的脂质纳米粒只包含四种成分:带正电荷的可电离脂质(其与带负电荷的信使RNA骨架结合),有助于稳定粒子的聚乙二醇化脂质,以及构成粒子结构的磷脂和胆固醇分子。成千上万的这四种成分包裹着信使RNA,保护它不受破坏性酶的影响,并将其穿梭到细胞中,在那里mRNA被卸载并用于制造蛋白质。虽然这个概念看起来很简单,但要完善它远不是那么简单。
在过去30多年的时间里,那些被实验室研究证明有前途的脂质在进行动物或人体实验时,往往不能取得理想的效果。带正电的脂质本身是有毒的,公司在研发安全有效的脂质纳米粒配方的路上挣扎了许多年。当静脉注射时,微粒总是在肝脏中积聚,无法输送到目标器官。另一个挑战是不同批次生产出的脂质纳米粒在质量上的一致性,目前生产COVID-19疫苗的一个限制因素就是制造这些颗粒所需的原材料。
脂质纳米粒的开发一直令人头痛,但如果没有这种脂质的封装,mRNA疫苗将一文不值。“这是整个事件的无名英雄,”Giuseppe Ciaramella说,他曾在2014年至2018年期间担任莫德纳(Moderna)公司的传染病主管。
疫苗被誉为是信使RNA技术成功应用的首个成果,也成为纳米颗粒领域的里程碑。虽然2018年美国食品药品监督管理局(FDA)批准了基于脂质纳米粒的第一种药物以用于一种罕见遗传病,但两种获批的用于COVID-19的信使RNA疫苗为纳米颗粒提供的机会远大于该领域创始人所能想象的。“这对每个从事药物控制释放研究的人来说都是一个有力的辩护,”麻省理工学院的化学工程师罗伯特·兰格说。
“在今年,脂质纳米粒将进入数百万人的手臂。”加拿大不列颠哥伦比亚大学的纳米颗粒科学家Pieter Cullis说。“上世纪80年代的边缘领域现在已经成为主流。”
(药物)递送困境
现代脂质纳米粒可以追溯到被称为脂质体的更简单系统上,脂质体是通常仅由两种或三种脂质组成的空心脂质球。上世纪80年代初,Cullis发现抗癌药物可以扩散到这些脂质体中,并滞留在空腔中。当把这些脂质体注射到患有癌症的动物体内时,脂质体会滑过肿瘤的渗漏血管,进入细胞并释放出药物。Cullis和其他几个人创办了公司,希望脂质体能够安全地将有毒药物输送到人体肿瘤中。
稳定性和工艺问题使这种技术进展缓慢。第一种基于脂质体的药物最终于1995年获得FDA批准,但到那时,Cullis和许多该领域的研究者们又面临新的挑战:利用脂质体来传递DNA和RNA等核酸。
当时,科学家们被遗传学的进展所吸引,这些进展有望通过给人递送新的基因或使致病基因沉默来治愈疾病。弄清楚如何将这些核酸疗法(DNA或RNA)导入细胞是一个重大挑战,这需要比传统脂质体更复杂的东西。Cullis知道在脂质体中加入带正电荷的脂质有助于平衡带负电荷的核酸,但存在一个问题。“自然界中没有阳离子脂质,”Cullis说。“而且我们知道不能使用永久带正电的脂质,因为它们毒性巨大。”他补充说,这些脂质会撕裂细胞膜。
解决方案来自于只在特定条件下才带电的新脂质。在90年代末到21世纪头十年间,Cullis与在Inex制药公司的同事,以及Inex衍生出来的Protiva生物疗法公司一起开发出可电离的脂质:即在酸性pH值下是带正电荷的,但在血液中是中性的。该小组还创造了一种利用这些脂质制造纳米颗粒的新方法,通过微流体将溶解在乙醇中的脂质与溶解在酸性缓冲液中的核酸混合。当这两种溶液流汇合时会自发形成脂质纳米粒,与中空脂质体不同,脂质纳米粒中充满了脂质和核酸。这个过程在理论上很简单,但要让机器可靠地制备质量一致的脂质纳米粒却很困难。
然而,在实验室里看起来不错的脂质纳米粒在临床上却不尽如人意。第一个版本的可电离脂质仍然有毒。而早期的纳米颗粒配方并不能足够快速降解,导致它们在反复注射后积累在体内。Protiva发现,它的一种实验性脂质纳米粒疗法在人类身上引起的免疫反应比实验室中更严重,该公司认为聚乙二醇化脂质是一个主要因素。
聚乙二醇化脂质(聚乙二醇(PEG)连接在脂质头上)在纳米粒子中具有多种功能。据Protiva的前科学家James Heyes介绍说,聚乙二醇有助于控制纳米颗粒大小,防止颗粒在储存过程中聚集,并初步保护颗粒不被体内免疫蛋白检测到。Heyes现在是脂质纳米粒公司Genevant Sciences的首席科学官,该公司起源于Protiva。
但聚乙二醇也有弱点。它阻止脂质纳米粒与帮助它们进入细胞的蛋白质结合。由于聚乙二醇延长了微粒在体内的循环时间,免疫系统有更多的时间发现微粒并开始产生抗体反应。尽管在许多化妆品、药品和食品中都有用到聚乙二醇,但科学家们推测,有些人可能会产生聚乙二醇抗体,给这些人注射聚乙二醇包被的纳米颗粒可能会引发过敏反应。
从胞内体中逃逸
到了2005年,一种新技术刺激推动了发展更好更安全的脂质纳米粒,这种技术被称为小干扰RNA(siRNA),用于选择性沉默基因。阿尔尼拉姆(Alnylam)制药公司成为小干扰RNA的领军企业,它很快意识到现有的纳米颗粒在帮助小干扰RNA进入细胞方面并不是很好。该公司建立了多个合作伙伴关系来生产新的脂质纳米粒,包括2005年与Protiva、以及2006年与Inex的合作。研究小组制造了300多个可电离脂质,首先优化脂肪尾部,然后调整可电离的头部基团以及处于头尾中间的连接区。这项工作非常繁重,在培养皿中能形成很好的纳米粒子的脂质在动物研究中往往会失败。“你可以拥有50种不同的可电离脂质,它们都能有效地传递给培养中的细胞,其中49种在体内根本不起作用,”曾在Inex工作、现任Acuitas Therapeutics首席执行官的托马斯·马登(Thomas Madden)回忆道。
马登解释说,脂质纳米粒利用一种被称为受体介导的内吞作用的自然过程进入细胞。当与细胞结合时,纳米颗粒被包裹在一个更大的脂质泡中,一种被称为胞内体的细胞器。胞内体内部的酸性环境质子化可电离脂质的头部,使它们带正电。这种正电荷引发了纳米颗粒形状的变化,科学家们认为这有助于纳米颗粒从胞内体中挣脱出来,最终将其携带的RNA货物释放到细胞质中。一旦释放,RNA就可以自由发挥作用了。
最有效的纳米粒是那些被人体误认为是低密度脂蛋白(LDL)胆固醇(通常称为坏胆固醇)的纳米粒。识别血液中低密度脂蛋白胆固醇的蛋白质结合在阿尔尼拉姆(Alnylam)纳米颗粒上,并将它们携带到肝细胞上的低密度脂蛋白受体上,然后使肝细胞将纳米颗粒吞噬进一个胞内体中。在皮氏培养皿中的研究忽略了这种复杂的相互作用。

“研究细胞内发生的事情已经做了很多工作,但试图理解这些纳米颗粒在到达细胞前发生的事完全是另一个问题。”卡内基梅隆大学(Carnegie Mellon University)的纳米颗粒科学家凯瑟琳•怀特黑德(Kathryn Whitehead)说。因此,“我们甚至不再进行体外筛选,”她说。“我发现直接在动物身上测试更能提供有价值的信息。”
甚至一些在动物身上表现良好的脂质纳米粒也被证明,在许多需要使用重复剂量的小干扰RNA治疗中毒性太大。“最大的问题是试图在有效、安全和可耐受的系统之间找到正确的平衡,”Marian Gindy说。Marian Gindy是默克制药公司(Merck&Co.)药物科学执行董事,她从2008年开始领导RNA配方团队,直到2013年默克终止小干扰RNA项目。“我想说的是,这仍然是这一领域的最大挑战。”
到了2010年,阿尔尼拉姆(Alnylam)已经成功地使用了一种叫做MC3的可电离脂质。使用MC3所需的纳米颗粒的剂量,约为使用较早的可电离脂质制备方法的千分之一。阿尔尼拉姆(Alnylam)在patisiran(Onpattro)中使用了这一新的配方,用于治疗一种罕见的疾病,称为遗传性甲状腺素介导的淀粉样变。2018年,patisiran成为第一个经批准的小干扰RNA药物,也是第一个经批准的通过脂质纳米粒递送的疗法。但这种药物需要每3周输注80分钟,并用多种抗炎药进行预处理,以尽量减少对纳米颗粒的反应。当patisiran在临床上崭露头角的时候,阿尔尼拉姆(Alnylam)已经把它的大部分脂质纳米粒工作放在一边,转而使用一种新的化学偶联技术,用它来将其它小干扰RNA疗法输送到皮下。
信使RNA的启动平台
在很短的一段时间内,脂质纳米粒的新工作都进行的不愠不火---直到专注于信使RNA的新公司为该领域带来了活力。成立于2008年的BioNTech和成立于2010年的莫德纳(Moderna)承诺,能够利用信使RNA在体内产生任何蛋白质以治疗疾病或作为疫苗。在过去的十年里,信使RNA的相关研究获得了数十亿美元的投资。从第1天开始,如何将这些信使RNA链传递到细胞中就是亟待解决的问题,但之前的小干扰RNA经验为后续工作提供了一个启动平台。
“早期人们认为用于小干扰RNA的脂质也可能对信使RNA有用。”麻省理工学院纳米医学和生物材料科学家丹Daniel Anderson说。他的团队开始与罕见疾病公司Shire Pharmaceuticals合作,将编码蛋白质药物的信使RNA封装起来,以治疗罕见的肝脏疾病。
为小干扰RNA设计的现成的脂质纳米粒制剂有时也对信使RNA起作用,但效果不是很好,Romesh Subramanian说,他从2014年到2017年领导了亚力兄制药公司(Alexion Pharmaceuticals)的一个团队,与莫德纳(Moderna)一起研究信使RNA疗法。他解释说,小干扰RNA分子就像两排短棒,每排大约有20个核苷酸。相比之下,信使RNA常常有超过数千个核苷酸,形成复杂的形状,并且用难以预测的方式改变脂质纳米粒的特性。
在意识到MC3不能有效递送信使RNA后,莫德纳(Moderna)投入了大量资源来构建更好的可电离脂质。“有一个化学家小组马上就开始构建新型阳离子脂质,”前莫德纳(Moderna)传染病主管Ciaramella说。他回忆说:“这有点像一个小分子药物发现引擎,但依赖于类固醇。”研究小组制造了大约100种可电离脂质,并在脂质的碳链中引入酯键,使其更易被生物降解。调整纳米颗粒中四种脂质的比例可以改变脂质纳米粒在体内的分布。“就脂质纳米粒而言,成败的关键就在细节上。”Ciaramella说。“但是一旦你针对一个器官对脂质纳米粒进行了优化,你就可以只需很少的优化,将它用于不同的信使RNA。”
这种适应性是关键。例如,莫德纳(Moderna)最近为南非首次发现的一种新变种冠状病毒制造了一种最新版本的COVID-19疫苗。该疫苗仍需进行临床试验,其信使RNA编码略有改变,以匹配新病毒株的基因编码,但脂质纳米粒配方保持不变。既然该公司知道了这种纳米颗粒可以发挥作用,它就可以一次又一次地将其用于不同的疫苗。
但关于莫德纳(Moderna)最初是如何达到最佳配方的细节却鲜有报道。该公司没有接受采访,谈论其纳米颗粒的开发,辉瑞和BioNTech也没有。对于COVID-19疫苗,莫德纳(Moderna)最终使用了一种被称为SM-102的可电离脂质,该脂质在2018年一项关于MC3替代品的研究中被首次描述。而辉瑞和BioNTech从Acuitas公司获得了一种名为ALC-0315的可电离脂质的许可。
这些离子化脂质在结构上非常相似,它们是公司在优化脂质纳米粒以进行系统给药和向肝脏给药时发现的,而不是在开发肌肉注射疫苗时发现的。专家指出,优化用于疫苗的纳米颗粒可以降低注射所需剂量,从而减轻大流行期间的制造负担。新的脂质和纳米颗粒配方可能需要很长时间才能在这次大流行中发挥作用,但莫德纳(Moderna)、BioNTech和其他人正在继续寻找更好的方法,将信使RNA导入细胞以用于各种用途。
脂质纳米粒的复兴
大流行重新激发了人们对继续完善脂质纳米粒的兴趣。致力于纳米颗粒研究的小公司接到越来越多的大制药公司的电话,他们希望使用小公司的脂质。有效的脂质纳米粒对于新的信使RNA疫苗、信使RNA治疗、DNA基因治疗甚至CRISPR基因编辑疗法都是至关重要的。
“每个人都在试图找出下一个有效的可电离脂质。”俄勒冈州立大学的纳米颗粒科学家Gaurav Sahay说。但他认为纳米颗粒研究人员也应该开始多关注脂质纳米粒的其它成分。Sahay说,他的实验室发现,使用替代版本的胆固醇分子可以大大提高递送效率。怀特黑德(Whitehead)说,尽管莫德纳(Moderna)和辉瑞-BioNTech的两种疫苗都使用相同的标准磷脂,但将这种成分换成不同的磷脂可能会使纳米粒子到达体内不同的细胞。
“对该领域来说将药物输送到特定的细胞和组织中仍然是一个巨大的挑战。”俄亥俄州立大学的纳米粒子研究员Yizhou Dong说。目前,静脉注射纳米颗粒很容易到达肝脏,肌肉注射疫苗被免疫细胞摄取。一些公司正在研究雾化输送到肺部的实验配方,但身体的其它部位仍然无法触及,这些部位对定向输送的需求很高。2月下旬,担任CRISPR 碱基编辑公司Beam Therapeutics总裁兼首席科学官的Ciaramella斥资1.2亿美元收购了初创公司Guide Therapeutics,该公司专注于脂质纳米粒的研究,并拥有一套系统,寻找针对人体特定细胞的颗粒。
“脂质纳米粒经历了一段黯淡的时代,”信使RNA公司Orna Theraphy的CEO 托马斯 巴尔内斯(Thomas Barnes)说。“我认为这些可电离脂质将复兴,世界将再次为脂质纳米粒感到兴奋。”
目前,COVID-19疫苗的成功是一个甜蜜的胜利。安德森说:“老实说,这有点超现实。这是从我们刚开始感到兴奋的新事物到一月份就变成了注射进我妈妈手臂里的东西。”
该报道由李杰为C&EN翻译。文章的原始英文版本如下。


Join the conversation
Contact the reporter
Submit a Letter to the Editor for publication
Engage with us on Twitter